W celu wyrażenia stężenia substancji w mieszaninie często stosuje się stężenie molowe wyrażające stosunek liczby moli (n) danej substancji do objętości mieszaniny (V), której skład wchodzi.
![]()
Objętość podajemy w dm3. Pamiętajmy, że 1 dm3 = 1 litr = 1000 ml = 1000 cm3
Warto wiedzieć, że parametr „n” wyrażający liczbę moli można zapisać zależnością łączące masę substancji z jej sumaryczną masą molową, czyli:
![]()
Daje nam to ostatecznie wzór:
![]()
Przykład. Masę molową azotanu srebra (AgNO3) możemy ustalić korzystając z układu okresowego pierwiastków, odczytujemy dla każdego pierwiastka poszczególne masy, czyli:
| Srebro(Ag) | 107,868 u |
| Azot (N) | 14,007 u |
| Tlen (O) | 15,999 u |
Jednostka „u” to tak zwany „unit”, czyli masa atomowa wyrażona w g/mol
Na tej podstawie, znając liczebność poszczególnych pierwiastków, sumujemy poszczególne masy:
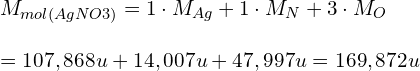
Pozostaje tylko odmierzyć odpowiednią ilość azotanu srebra i rozpuścić go w ustalonej objętości wody. Dla przykładu, stężenie 0,5g AgNO3 jakie uzyskamy po rozpuszczeniu w 100 ml wody (czyli 0,1 dm3) wyniesie:
![]()
Jednostkę mol/dm3 zapisuje się też wielką literą M. Powyższy wynik możemy zapisać jako 29 mM, czyli stężenie pół grama azotanu srebra rozpuszczonego w 0,1 litra wody wynosi 29 milimola.
